|
||||||||||||
| 购买进口仪器、试剂和耗材——就在始于2001年的毕特博生物 www.bitebo.com |
清华大学生命学院高宁、雷建林研究组报道了大肠杆菌核糖体大亚基和ObgE复合物的冷冻电镜结构,并结合生化数据证明了ObgE与核糖体大亚基结合的机制,进而探讨了ObgE在核糖体大亚基成熟阶段、以及氨基酸饥饿条件下对蛋白质翻译的调控机理。相关文章发表于2014年5月20日的《PLOS biology》杂志上。 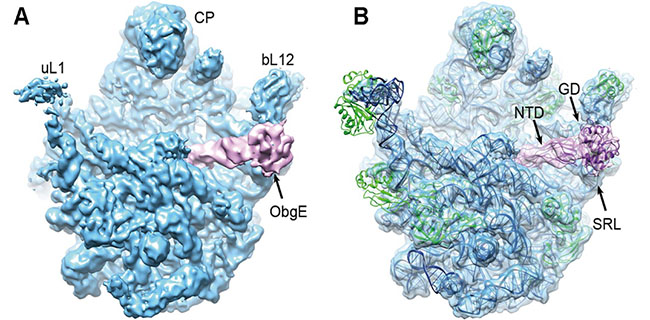 图示为ObgE结合的50S核糖体亚基复合物的5.5 Å冷冻电镜结构及原子模型。 一个正常的细菌细胞中包含上万个由大小两个亚基组成的核糖体,参与合成细胞生长所需的各种蛋白质。在过去的二十年里,尽管核糖体催化的蛋白翻译分子过程和机理得到了精细的理解,但是蛋白翻译过程是如何受到细胞内各种的信号通路调控还不甚明确。当生长条件严苛,如氨基酸饥饿的时候,依旧盲目的合成蛋白就显得得不偿失,此时细菌需要将所有的能量集中于保持存活,细菌的这种策略叫做“严紧反应”(Stringent Response),其中的氨基酸饥饿反应就由一种小分子信号素(p)ppGpp介导。 已有的研究显示,(p)ppGpp可以抑制一系列细菌的基本生理过程,包括染色体复制,基因转录,最终都间接的影响蛋白质翻译。同时也有一些证据表明(p)ppGpp也可以直接影响翻译过程本身,但其中的机理却尚不明确。 本研究针对一种细菌中保守的GTP酶ObgE展开研究。本文首先证实了ObgE蛋白可以与核糖体大亚基结合,这一结合反应依赖于核酸,并且在(p)ppGpp结合的条件下最为紧密。70S核糖体组装的动力学研究结果显示,ObgE以竞争性的方式结合于核糖体大亚基上,从而阻碍核糖体小亚基的结合,从而抑制下游的翻译起始过程。 冷冻电镜结构分析表明,ObgE巧妙的结合于核糖体大小亚基的界面,占据了众多翻译因子的结合位点,展现出一种典型的 “抗结合因子”特征。这些结果表明ObgE作为一种(p)ppGpp结合蛋白/效应因子,可以感知细胞内的生长调控信号,特异的结合到处于组装晚期的不成熟核糖体大亚基中间体和处于翻译间期的静息状态的成熟大亚基,从而在全局水平下调细胞内的核糖体组装及蛋白翻译过程。 清华大学生命学院2010级博士生冯博雅为本文第一作者,清华大学生命学院高宁、雷建林、及瑞典乌普萨拉大学Suparna Sanyal博士为共同通讯作者。清华大学生命学院吴嘉炜教授、王志新教授、以及2009级博士生王杰参与了本文中酶活测定的部分。本研究得到了国家基金委自然科学基金,科技部重大研究计划,清华大学自主科研项目的资助,数据处理和结构计算得到了国家蛋白质科学基础设施(北京)和清华大学“探索100”高性能计算平台的支持。 原文摘要: Structural and Functional Insights into the Mode of Action of a Universally Conserved Obg GTPase Boya Feng, Chandra Sekhar Mandava, Qiang Guo, Jie Wang, Wei Cao, Ningning Li, Yixiao Zhang, Yanqing Zhang, Zhixin Wang, Jiawei Wu,Suparna Sanyal, Jianlin Lei, Ning Gao Obg proteins are a family of P-loop GTPases, conserved from bacteria to human. The Obg protein in Escherichia coli (ObgE) has been implicated in many diverse cellular functions, with proposed molecular roles in two global processes, ribosome assembly and stringent response. Here, using pre-steady state fast kinetics we demonstrate that ObgE is an anti-association factor, which prevents ribosomal subunit association and downstream steps in translation by binding to the 50S subunit. ObgE is a ribosome dependent GTPase; however, upon binding to guanosine tetraphosphate (ppGpp), the global regulator of stringent response, ObgE exhibits an enhanced interaction with the 50S subunit, resulting in increased equilibrium dissociation of the 70S ribosome into subunits. Furthermore, our cryo-electron microscopy (cryo-EM) structure of the 50S·ObgE·GMPPNP complex indicates that the evolutionarily conserved N-terminal domain (NTD) of ObgE is a tRNA structural mimic, with specific interactions with peptidyl-transferase center, displaying a marked resemblance to Class I release factors. These structural data might define ObgE as a specialized translation factor related to stress responses, and provide a framework towards future elucidation of functional interplay between ObgE and ribosome-associated (p)ppGpp regulators. Together with published data, our results suggest that ObgE might act as a checkpoint in final stages of the 50S subunit assembly under normal growth conditions. And more importantly, ObgE, as a (p)ppGpp effector, might also have a regulatory role in the production of the 50S subunit and its participation in translation under certain stressed conditions. Thus, our findings might have uncovered an under-recognized mechanism of translation control by environmental cues. |
购买进口仪器、试剂和耗材——就在始于2001年的毕特博生物
www.bitebo.com |
|