|
HPV16型早期蛋白基因后端粒酶的活性表达
第一军医大学学报1999年第19卷第5期
人成纤维细胞转染
吴 翔 朱 冰 杨光彩 徐 钤
摘 要 用已构建的含有HPV16的早期蛋白的质粒载体:pME6SN、pME7SN和pME6E7SN经脂质体介导,转入正常的人成纤维细胞。经G418选择筛选及鉴定后证实,E6、E7、E6E7转化的细胞寿命延长;E6、E6E7表达的细胞中有端粒酶的表达,E7表达的细胞中未能检测到端粒酶的表达。提示端粒酶的表达是细胞转化后的一个后续事件。
关键词:人乳头瘤病毒 E6 E7 人成纤维细胞 端粒酶
自70年代末以来,不断增加的流行病学、病理学和分子生物学的证据表明:人乳头瘤病毒(Human papillomavirus, HPV)与宫颈癌的关系非常密切。宫颈癌及其癌株细胞(Hela)中可检测到特异性的HPV早期蛋白,而其中有些蛋白(如HPV16E6、E7蛋白)的编码基因被证实为转化基因。1996年,Klingelhutz[1]等用人乳头瘤病毒的E6、E7、E6E7基因转入正常人角质细胞和上皮细胞后发现,细胞出现生存代数延长和永生化现象,证实当时细胞永生化与端粒酶的表达有关。1997年,Shiga[2]将HPV16的E6、E7、E6E7基因转入人成纤维细胞后,发现细胞出现形态学方面的改变,细胞中出现端粒酶的表达。
本研究率先在国内用检测端粒酶活性表达的方法进一步研究癌基因在肿瘤发生、发展中的作用。通过研究人成纤维细胞转染HPV16E6、E7癌基因对端粒酶的活性表达作用,进一步研究HPV16E6、E7基因的致癌机理及其相互关系,从而为人乳头瘤病毒的早期诊断和治疗探讨新的手段和途径。
1 实验材料
1.1材料
1.1.1 质粒 pMSN重组质粒由pMDSG质粒改造构建而成。在pMSN的Xba1位点分别插入HPV16E6、E7和E6E7基因,所得重组质粒分别称为pME6SN,pME7SN和pME6E7SN,由德国de Villiers博士惠赠,本室保存。
1.1.2引物 CX、TS、P1、P2、P3、P4、P5、P6,由中科院上海植物生理所植物分子遗传国家重点实验室合成(表1)。
表1 实验中使用的引物
Tab. 1 Primers in assay
|
Name
|
Sequence
|
Usage
|
|
CX
|
5’CCCTTACCCTTACCCTTACCCTAA3’ |
Amply telomerase |
|
TS
|
5’AATCCGTCGAGCAGAGTT3’ |
Amply telomerase |
|
P1
|
5’TTAGAACAGCAATACAACAAAC |
Amply E6 fragment |
|
P2
|
5’ACCGGTCCACCGACCCCTTA |
Amply E6 fragment |
|
P3
|
5’TAGAGTCACACTTGCAACAA |
Amply E7 fragment |
|
P4
|
5’GAGACAACTGATCTCTACTG |
Amply E7 fragment |
|
P5
|
5’TTAGAACAGCAATACAACAAAC |
Amply E6E7 fragment |
|
P6
|
5’TAGAGTCACACTTGCAACAA |
Amply E6E7 fragment |
1.1.3 研究对象 人成纤维细胞(Normal human fibroblast, NHF)
1.2 主要试剂
1.2.1 细胞培养试剂 DMEM高糖培养基(Gibco BRL公司),胎牛血清(杭州四季青公司),LIPOFECTAMINE( Gibco BRL公司),G418( Gibco BRL公司)。
1.2.2 提细胞DNA裂解液 广州达安医学诊断公司。
1.2.3 TRAP法中使用的细胞裂解工作液I (4℃保存) 10 mol/L Hepes-KOH,1.5 mol/L MgCl2,10 mol/L KCl,1 mol/L DTT。
1.2.4 TRAP法中使用的细胞裂解工作液II(4℃保存) 10 mol/L Tris-HCl (pH7.5),1 mol/L MgCl2,1 mol/L EGTA,0.1 mol/L AEBSF,0.55%CHAPS,5 mol/L b -巯基乙醇,10%甘油。
1.2.5 酶转录反应缓冲液成分 20 mol/L Tris-Cl(pH8.3),1.5 mol/L MgCl2,63 mol/L KCl,0.005% Tween-20, 1 mol/L EGTA,50 μmol/L dNTP,1μg T4g32蛋白。
2 实验方法
2.1细胞培养及收获
2.1.1 人成纤维细胞的传代培养 取传代培养的人成纤维细胞,弃去瓶中的培养液,加入0.25%的胰蛋白酶消化。按1:3的比例传代。置37℃,5%CO2,饱和湿度环境下培养,建立皮肤组织成纤维细胞的传代体系。
2.1.2 培养细胞的收获 若需收集细胞,将消化后的细胞全部转入离心管中,8 000 g%26acute; 10 min,室温离心,收集细胞团块。
2.2 HPV16的早期蛋白基因转染人成纤维细胞 参见文献[3]及GIBCO公司Lipofectamin试剂产品说明书上的方法进行,传第3代(1~2)%26acute; 105个细胞到60 mm的培养皿内。约2周后,可见有抗性克隆形成,待其逐渐长大,出现转化灶后,采用刮除法以获得纯的转化细胞群。
2.3 转染细胞的鉴定 取灭菌的0.5 ml离心管一个,PCR反应总体积为50μl,收获培养的细胞加入提细胞DNA裂解液,100℃水浴处理10 min,1 000 g×10 min离心后取上清作为反应模板。加50 pmol/L的引物P5-P10(引物配对方式见实验材料1.1.2部分,分别扩增E6,E7,E6E7片段)各2μl,模板0.5μg等反应液,混匀后,进行PCR扩增。取5μl反应液,在8%的聚丙烯酰胺凝胶上稳压150 V电泳2 h,银染。
2.4 细胞转化后端粒酶活性的测定
2.4.1 细胞中端粒酶的提取,表达水平的测定 参照文献[4]的TRAP方法
2.4.2 非放射性银染技术对TRAP产物进行观察
2.4.2.1电泳 取TRAP产物30 m l及标准分子量(PBR322DNA/HaeIII)1 m g,分别与适量加样缓冲液混合上样进行12%的聚丙烯酰胺凝胶电泳,电压200 V,恒压电泳4 h。
2.4.2.2银染 取下凝胶,置10%乙醇内固定10 min,水洗2次;1%硝酸内脱色3 min,水洗2次;0.012 mol/L硝酸银染色液避光染色20 min,水洗3次;0.28 mol/L Na2CO3-0.019%甲醛显影液,直至产物信号足够强而背景不致过高为止;用10%的冰醋酸终止反应,水漂洗后制干胶保存或拍照。
2.4.2.2 对图象进行计算机扫描分析 将染好的胶置于凝胶图象分析系统拍照。
3 实验结果
3.1 转化细胞的克隆及筛选 正常人成纤维细胞(图1-A)伸展良好,折光性较弱,单层生长,有方向性和接触抑制作用。在含G418 (400 mg/L)的培养液中,第3 天开始死亡(图1-B),而由质粒r MSN重组系列转染的人成纤维细胞经G418(400 mg/L)筛选培养2周后,逐渐形成大小不等的细胞转化灶(图2)。
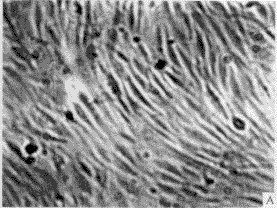
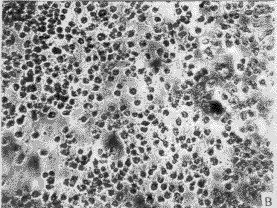
图1 正常传代培养的人成纤维细胞(A)及加入G418后的正常人成维细胞(B)
Fig. 1 Normal NHF (A) and normal NHF added with G418(B)
a: Primary cells at passage (P) 3,characterized by stretching well, growth with direction and contact-inhibition; B: Primary cells were introduced by blank vectors, All of them died after 5 days with G418 400 mg/L ×100
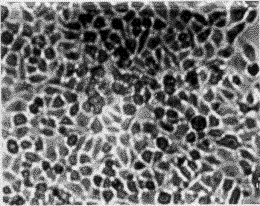
图2 pME6SN、pME7SN、pME6E7SN转染的人成纤维细胞2周后出现转化灶
Fig. 2 NHFs introduced by pME6SN, pME7SN, pME6E7SN
producing transfected clone after 2 weeks ×100
经pME6SN、pME7SN、pME6E7SN转化的细胞出现细胞大小不一,生长方向紊乱,接触抑制消失,呈重叠性生长,伸展性较差,折光性强,形态类似于上皮细胞等恶性细胞表型特征。而不含HPV任何基因的空载体r MSN转化的细胞,具有接触抑制作用,有方向性单层、不重叠生长,其细胞特征与正常人成纤维细胞生长相似。
3.2转化细胞的鉴定结果 所设计的3对引物分别对HPV的E6、E7、E6E7基因是特异的,扩增后的片段为140、138和387 bp,与预期的结果完全一致(图3)。
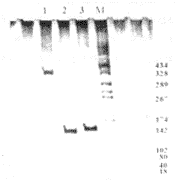
图3 转化细胞的鉴定
Fig. 3 Identification of cells transformed by PCR, 8% non-denaturing PAGE ,150 V for 2 hours and silver-staining
1: NHF introduced by pME6E7SN; 2: NHF introduced by pME7SN; 3: NHF introduced by pME6SN; M: marker
3.3 人成纤维细胞经HPV16早期蛋白基因转染后检测端粒酶活性 从不同细胞端粒酶表达的时间先后来看,HPV16E6基因转染人成纤维细胞后的第15代(从细胞原代培养开始计算生存代数,下同)出现端粒酶的表达;HPV16E7基因转染人成纤维细胞后直至细胞死亡(第19代),一直未检测到端粒酶的表达;HPV16E6E7基因转染人成纤维细胞后的第14代即可检测到端粒酶的表达;而正常细胞和经pMSN转染的细胞只能生长至第10代和第13代,未检测到端粒酶的表达(图4)。
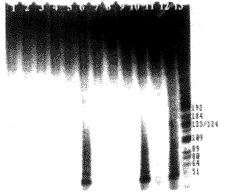
图4 pMSN重组质粒转染人成纤维细胞后端粒酶的表达情况
Fig.4 Telomerase activities of NHFs transfected by pMSN recombinant plasmids were analyzed by TRAP method
1: NHF; 3: NHF introduced by pMSN; 5: NHF introduced by pME6SN; 7: NHF introduced by pME7SN; 9: NHF introduced by pME6E7SN; 11: Hela cell; 2,4,6,8,10,12: cell extracts pretreated at 100℃ for 10 min; 13: marker (pBR322DNA/HaeIII)
4 讨论
细胞经pMSN、pME6SN、pME7SN、pME6E7SN质粒载体转染后,仅在pME6SN、pME6E7SN 转染的细胞检测出端粒酶的表达,而在pMSN、pME7SN转染的细胞中未能检测出端粒酶的表达。HPV16E6E7基因转染的细胞中端粒酶出现最早,在转染后,细胞生长的第14代即有检出信号,HPV16E6基因转染的细胞要到细胞生长的第15代才有检出信号。这与Klingelhutz[5]的实验结果吻合,Klingelhutz认为细胞转入HPV16基因后早期就有端粒酶的表达。
实验中还发现E6,E6E7基因可致使细胞表达端粒酶,E7基因不能激活端粒酶的表达,但细胞依然出现了恶性转变特性。这与Stoppler[6]的实验结果相同。
由HPV16E7转染的细胞,在每代生长时,都检测了端粒酶的活性,但一直未发现端粒酶出现活性,在细胞正常传代的第19代出现细胞衰老现象,无法继续传代而死亡。正常细胞及经空质粒载体转染的细胞传代至第10代和第13代死亡。
这些时间数据同时也说明,人成纤维细胞经E6、E7、E6E7转染后确实能延长细胞的寿命,细胞寿命的延长与端粒酶的表达可能有关,同时也说明肿瘤发生是多因素引起的。
在我们研究的转化细胞中E6,E6E7基因转染的细胞中可以检出端粒酶,空质粒载体及E7基因转染的细胞中不能检测到端粒酶。E7基因转染后的细胞,虽然我们观察到细胞形态学出现变化,但端粒酶活性的检测结果始终是阴性,或许E7基因维持细胞的恶性表型,并不完全依靠端粒酶的表达,可能还有其他机制来维持端粒的长度,如重组途径,反转录途径或救援途径[7]。在酵母的研究中已得到证实[8]。在Kim[4]等人的研究中也发现虽然多数肿瘤组织中端粒酶活性很高,但仍有少数恶性肿瘤不能观察到该酶的活性,推测有可能是这些细胞逃逸了M1期,具有一定的增殖能力,但端粒酶尚未被激活,所以并不能无限增殖。
可能HPV16E6基因像降解p53一样,使另一抑癌基因降解而导致端粒酶基因被激活,而不受抑制地表达,在这一点上E7可能不同,它不能使另一抑癌基因被降解,从而无法对端粒酶的表达出现影响,不显示出端粒酶的激活表达,这一推测有待于在今后的研究工作中进一步证实。
作者简介:吴 翔,男,1970年出生;发表论文两篇;电话81936697
作者单位:吴 翔 杨光彩 徐 钤 第一军医大学生物化学教研室,广州,510515 朱 冰 儿童医院病毒室,广州,510130
参考文献
1 Klingelhutz AT, Foster SA, McDougall JK et al. Telomerase activation by the E6 gene product of human papillomavirus type16. Nature 1996,380(6569):79
2 Shiga T, Shirasawa H, Shimiyu K. Normal human fibroblasts immortalized by introduction of human papillomavirus type 16(HPV16) E6-E7 genes. Microbiol Immunol,1997,41(4):313
3姜 泊. 分子生物学常用实验方法,第二版.北京:人民军医出版社.1996, 34~41
4 Kim NW, Piatyszek MA, Prowse KR. Specific association of human telomerase activity with immortal cells and cancer. Science, 1994, 266(23):2011
5 Klingelhutz AJ, Foster SA, McDougall JK. Telomerase activation by the E6gene product of human papillomavirus type16. Nature, 1996, 380 (6569):79
6 Stoppler H,Hartmann DP,Sherman J. The human papillomavirus type16E6 and E7 oncoproteins dissociate cellular telomerase activity from the maintenance of telomere length. J Biol Chem, 1997,272(20):13332
7 Pluta AF, Zakian VA. Recombination occurs during telomere formation in yeast. Nature, 1989,337(6206):429
8 Mceachern MJ, Cohn M, Blackburn EH. The yeast kluyveromyces lactis as a model system to study telomere length regulation and the ability of cells to grow in the absence of telomerase. PAACR, 1995,36:670
|